

帕拉米韋注射液說明書
-
【 通用名稱 】帕拉米韋注射液
-
【 商品名 】
朗好
-
【 規格 】15ml:0.15g(按 C15H28N4O4計)
-
【 包裝 】中硼硅玻璃安瓿,4 支/盒。
-
【 批準文號 】
國藥準字H20244152
-
【 適應癥 】用于治療甲型或乙型流行性感冒。
-
【 說明書 】
本品為處方藥,請在醫生指導下購買和使用。本網站資料僅供醫學藥學人士閱讀,不可作為個人用藥和處方依據。
藥品詳情
臨床文獻
|
【
藥品名稱
】
|
通用名稱:帕拉米韋注射液
英文名稱:Peramivir Injection
漢語拼音:Palamiwei Zhusheye
|
|
【
成份
】
|
本品活性成份為帕拉米韋。
化學名稱:(1S,2S,3R,4R)-3-[(1S)-1-乙酰氨基-2-乙基丁基]-4-胍基-2-羥基環戊烷-1-羧酸三水合物
化學結構式:
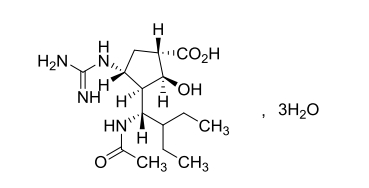 分子式:C15H28N4O4·3H2O
分子量:382.45
輔料:氯化鈉、氫氧化鈉、鹽酸、注射用水。
|
|
【
性狀
】
|
本品為無色的澄明液體。
|
|
【
適應癥
】
|
用于治療甲型或乙型流行性感冒。
|
|
【
規格
】
|
15ml∶0.15g(按 C15H28N4O4計)
|
|
【
用法用量
】
|
成人:常用劑量為每次帕拉米韋 300mg,經 15 分鐘以上單次靜脈滴注。
對于因合并癥等病情可能會加重的患者,劑量為每日一次 600mg 并經 15 分鐘以上單次
靜脈滴注,根據癥狀可連續多日重復給藥。此外,根據年齡及癥狀可酌情減量。
兒童:常用劑量為每日一次帕拉米韋 10mg/kg,經 15 分鐘以上單次靜脈滴注,根據癥
狀可連續多日重復給藥。每次劑量不得超過 600mg。
用法用量方面的使用注意事項:
1.出現癥狀后,最好盡快使用本品開始治療。對于出現癥狀超過 48 小時后才開始治療
的患者,尚未獲得證明本品有效性的數據。
2.根據體溫等臨床癥狀判斷需要繼續用藥的情況下才可以重復給藥,不可盲目地持續治
療。此外,3 日以上重復給藥的應用經驗有限。
3.腎功能損害患者:應根據腎功能降低的程度,按下表所示相應地調整劑量。本品重復
給藥時,也應按下表調整劑量
表 1 腎功能損害患者劑量調整
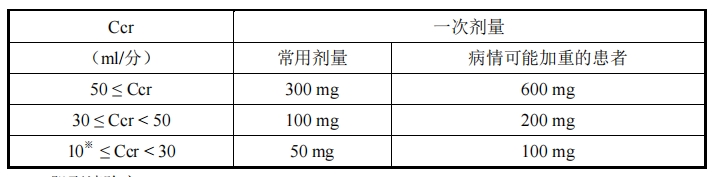 Ccr:肌酐清除率
※:對于肌酐清除率低于 l0ml/分的患者以及透析患者,應謹慎地調整劑量。帕拉米韋可經
血液透析迅速從血漿中清除。
|
|
【
不良反應
】
|
根據國外文獻報道的不良反應:
嚴重不良反應
1.休克、過敏性反應(發生頻率未知)
癥狀可見血壓過低、面色蒼白、出冷汗、呼吸困難、蕁麻疹等。
2.白細胞減少、中性粒細胞減少(1~ <5%)
3.急性肝炎、肝功能損害、黃疸(發生頻率未知)
在治療早期(給藥次日)可見伴有 AST、ALT、γ-GTP、A1-P 顯著升高的肝功能損害、
黃疸。
4.急性腎損害(發生頻率未知)
5.精神神經癥狀(意識障礙、譫妄、幻覺、妄想、痙攣等)、異常行為(發生頻率未知)。
盡管因果關系不明,但是感染流感時,可能會出現導致跌倒等的異常行為(急速走路,步履
蹣跚等)。
6.肺炎(發生頻率未知)
7.中毒性表皮壞死松解癥(TEN)、史蒂文斯-約翰孫綜合征(Stevens-Johnson 綜合征)
(發生頻率未知)
8.血小板減少(發生頻率未知)
9.出血性結腸炎(發生頻率未知)
10.其他不良反應
表 2 不良反應發生情況
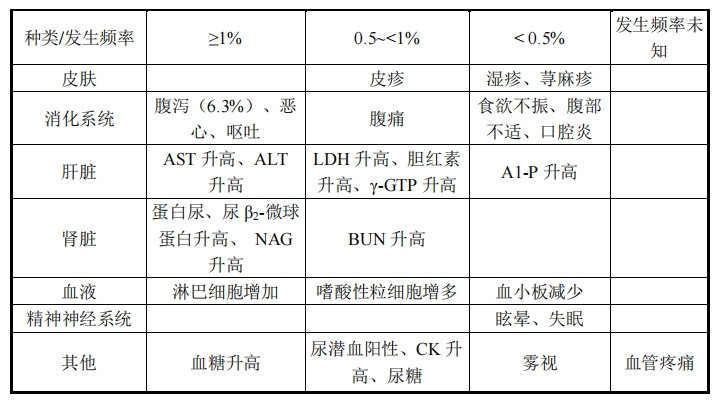 |
|
【
禁 忌
】
|
對本品成分有過敏史的患者不得用藥。
|
|
【
注意事項
】
|
1.本品治療時,應謹慎考慮本品的必要性。
? 鑒于并非所有甲型或乙型流感病毒感染患者都必須使用抗病毒藥物,在本品治療
時應仔細觀察患者的狀態,并謹慎考慮本品治療的必要性。
? 鑒于本品為靜脈滴注制劑,應充分考慮口服制劑和吸入劑等其他抗流感病毒藥物
是否可用,并研究本品治療的必要性。
? 注意流感病毒的耐藥性信息,研究使用本品治療是否適當。
? 本品對丙型流感病毒感染沒有療效。
? 本品對細菌感染沒有療效。
2.不論是否使用或使用何種類的抗流感病毒藥,在感染流感時均報告有出現異常行為的
癥例。
作為因異常行為引起跌倒等意外事故的預防措施,應向患者及家屬說明:
? 有出現異常行為的風險,
? 在自家養病時,至少應在發燒后兩天期間向護理人員等講解防止跌倒等事故的措
施。
此外,可導致跌倒等意外事故的嚴重異常行為大多報告于入學后的兒童、未成年男性等,
并且多發生在發燒后的兩天期間。
3.細菌感染癥合并流感病毒感染時,可能會與流感樣癥狀相混淆。對于細菌感染癥以及
疑似為細菌感染癥時,需要給予抗菌劑等進行適當處置。
4.因在治療早期(如給藥次日)即可出現肝功能損害、黃疸,因此在給藥后應立即密切
監測患者的狀態,如進行肝功能檢查。
5.因可能出現休克及過敏性反應,在給藥期間應在能夠進行緊急治療的狀態下密切監測
患者的狀況。此外,即使在給藥結束后也可出現休克、過敏性反應,因此應予以注意。
6.輔料成分(氯化鈉、注射用水)可引起鈉負荷及循環血液容量增加,可能會造成心臟
負擔,對于心臟、循環系統功能障礙的患者癥狀可能會加重。
7.對于腎功能損害患者,應根據肌酐清除率值相應地調整劑量,監測患者的狀況并謹慎
用藥。本品為經腎排泄的藥物,因此血藥濃度可能會持續較高。此外,輔料成分(氯化鈉、
注射用水)容易造成水分、氯化鈉過量,進而癥狀可能會加重。
【孕婦及哺乳期婦女用藥】
對孕婦或可能懷孕的女性用藥時,僅可在經判斷后認為治療效益大于風險時才能用藥。
大鼠實驗中報告本品可透過大鼠胎盤,家兔實驗中報告有流產和早產。
對哺乳期母親,應權衡治療及母乳喂養的必要性,考慮繼續或中止哺乳。據報告,本品
可向大鼠乳汁中分泌。
|
|
【
孕婦及哺乳期婦女用藥
】
|
對孕婦或可能懷孕的女性用藥時,僅可在經判斷后認為治療效益大于風險時才能用藥。
大鼠實驗中報告本品可透過大鼠胎盤,家兔實驗中報告有流產和早產。
對哺乳期母親,應權衡治療及母乳喂養的必要性,考慮繼續或中止哺乳。據報告,本品
可向大鼠乳汁中分泌。
|
|
【
兒童用藥
】
|
尚未開展低體重出生兒、新生兒、腎功能損害兒童等人群的臨床試驗。
|
|
【
老年用藥
】
|
在給藥時應監測患者的狀況。通常來說,大多數老年人的生理功能下降。
|
|
【
藥物相互作用
】
|
帕拉米韋對主要的人類肝細胞色素 P450(CYP)酶 CYP1A2、2A6、2C9、2C19、2D6、
2E1 及 3A4 未顯示出抑制作用,對 CYP1A2、2A6、2C9、2D6 及 3A4 未顯示出誘導作用。
此外,帕拉米韋不是 P-糖蛋白的底物,對 P-糖蛋白介導的藥物轉運也未顯示出抑制作用(體
外試驗)。
|
|
【
藥物過量
】
|
據報告,本品經血液透析可迅速從血漿中清除。
|
|
【
臨床藥理
】
|
血藥濃度
對健康成人男性受試者每組 6 例單次靜脈滴注 l00mg、200mg、400mg、800mg
注 1,血
漿藥物濃度變化如圖 1 所示,單次/重復靜脈滴注時的藥代動力學參數如表 3 和表 4 所示。
Cmax及 AUC 均呈劑量比例關系增加,帕拉米韋迅速被清除,平均滯留時間(MRT)約 3 小
時。相比單次給藥,重復給藥時的藥代動力學幾乎沒有變化,未見蓄積性。
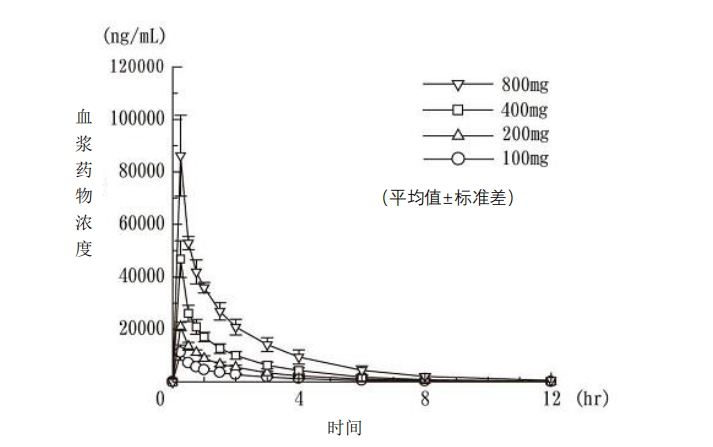 圖 1 單次給藥時的血漿藥物濃度(健康成人)
表 3 單次給藥藥代動力學參數
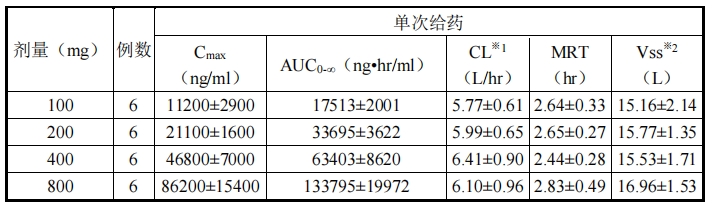 表 4.重復給藥藥代動力學參數
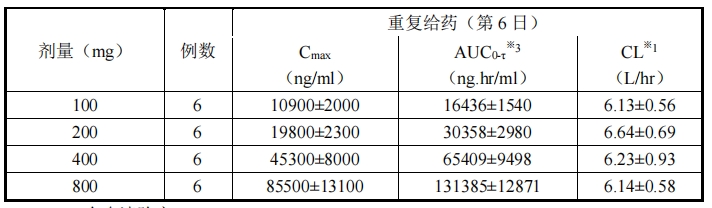 ※1:全身清除率
※2:穩態分布容積
※3:穩態給藥間期(24 小時)的 AUC
(測定法:LC/MS/MS)(平均值±標準差)
分布
人體組織分布
對健康成人男性受試者每組 6 例單次靜脈滴注 l00mg、200mg、400mg、800mg 注 1,上
呼吸道分泌液(咽喉分泌液及鼻腔分泌液)中的藥物濃度隨劑量相應增加。研究發現,相
比于血漿,有 3~9%(基于 AUC)分布到上呼吸道分泌液中。此外,400mg 劑量給藥時,
咽喉分泌液及鼻腔分泌液中的峰濃度分別為 930 及 1210ng/ml。
大鼠組織分布
對大鼠單次靜脈給藥[ 14C]-帕拉米韋 24mg/kg,所有組織中的放射性濃度均在給藥后 5
分鐘達到峰濃度。此外,研究發現本品在作用部位肺及氣管中分布良好,主排泄器官腎臟
中觀察到有較高的分布。所有組織中的放射性濃度在給藥后 48 小時以內降低至定量限之
下,這表明組織蓄積性及殘留性很低。此外,本品的腦內分布極低。
蛋白結合率
在 1~100 μg/ml 的濃度范圍內,人血清蛋白結合率(超濾法)為 0.3~1.8%(體外試
驗)。
代謝
對健康成人男性受試者 6 例單次靜脈滴注 400mg,血漿及尿中未檢出代謝物,僅檢測
到原型藥物。
排泄
對健康成人男性受試者每組 6 例單次靜脈滴注 l00mg、200mg、400mg、800mg 注 1,給
藥后 48 小時內的尿排泄率(平均值)為 86.3~95.4%,6 日重復給藥時相對總劑量的尿中排
泄率(平均值)為 77.2~92.6%。
特殊人群
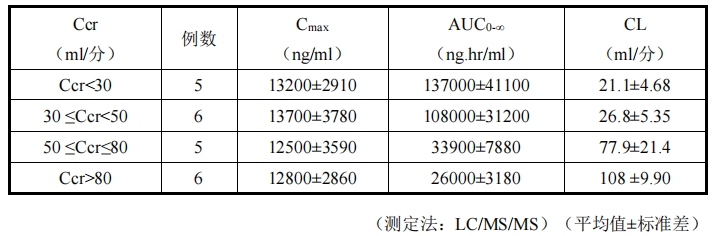
腎功能損害者
使用從日本人健康成人及流感患者以及國外健康成人、腎功能損害者及健康老年人的
臨床試驗中獲得的 332 例受試者及 3199 個血漿藥物濃度數據點,進行了群體藥代動力學分
析。在帕拉米韋藥代動力學(CL)的影響因子中,腎功能損害(Ccr)對藥代動力學的影
響較大,必須根據 Ccr 相應地調整劑量。
各腎功能損害者組中,劑量調整時(相當于 300mg)的血漿藥物濃度曲線如圖 2。此
外,各腎功能損害者組中劑量調整時的 Cmax及 AUC 如表 5 所示。
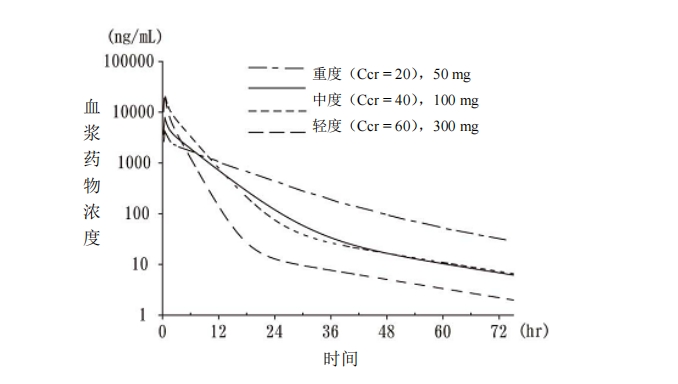 圖 2 腎功能損害者組中劑量調整時(相當于 300 mg)的血漿藥物濃度曲線
表 5 腎功能損害者組中劑量調整時的 Cmax及 AUC※
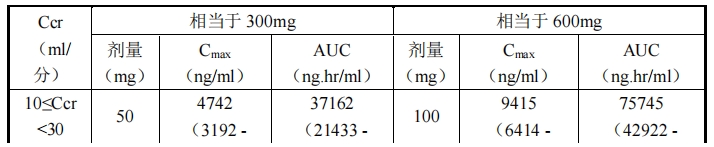 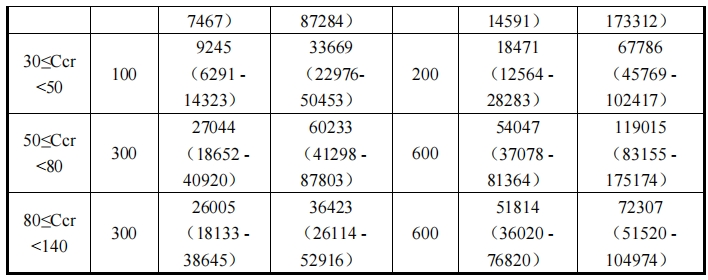 ※:中位值(90%預測范圍),使用基于群體藥代動力學分析軟件 NONMEM®的藥代動力
學參數的曲線結果
? 對 22 例受試者(包括腎功能損害者)單次靜脈滴注 2mg/kg 注 2,血漿藥物濃度如圖 3
所示,藥代動力學參數如表 6 所示。隨著腎功能下降,帕拉米韋從血漿中清除延遲,
AUC 增大(國外人的數據)。
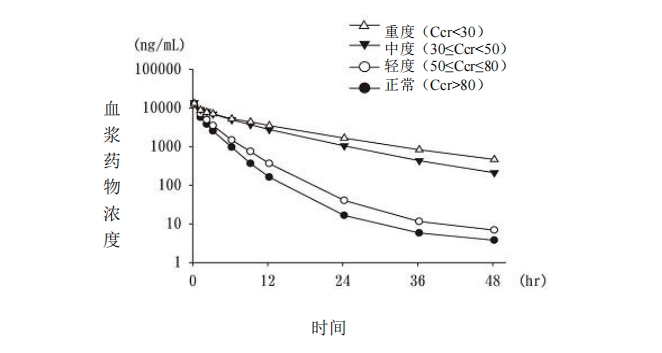 圖 3 單次給藥時的血漿藥物濃度(腎功能損害者)
表 6 包括腎功能損害患者的藥代動力學參數
 ? 對血液透析患者 6 例單次靜脈滴注 2mg/kg 注 2,血漿藥物濃度如圖 4 所示。從滴注 2
小時后開始進行 4 小時血液透析,血漿藥物濃度約降低 1/4(國外人的數據)。
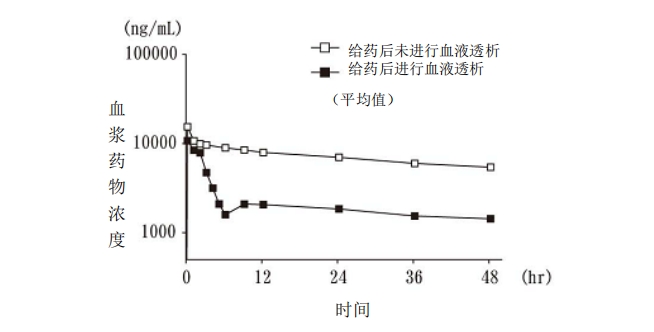 圖 4 單次給藥時的血漿藥物濃度(血液透析患者)
兒科患者
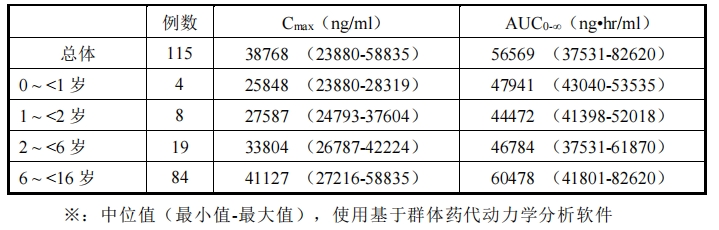
對兒科患者 115 例(4 個月~15 歲)單次靜脈滴注 10mg/kg(體重 60kg 以上的劑量為
600mg),滴注結束后 4 小時內的血漿藥物濃度(185 個數據點)如圖 5 所示。此外,使用
能測出血漿藥物濃度的所有 297 個數據點進行了群體藥代動力學分析,所得的藥代動力學
參數如表 7 所示。
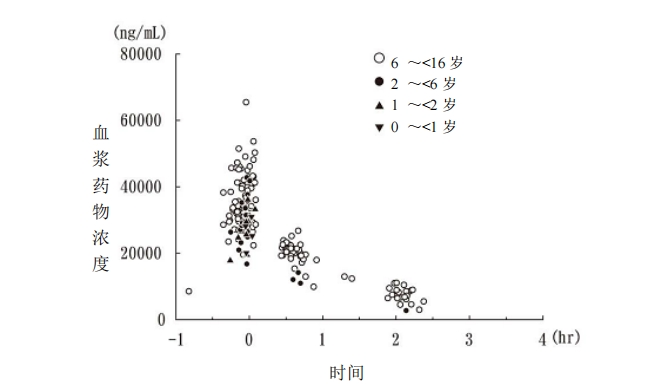 圖 5 單次給藥時的血漿藥物濃度(兒科患者)
表 7 兒科患者藥代動力學參數※
 NONMEM®的藥代動力學參數的貝葉斯(Bayesian)估計值
老年人
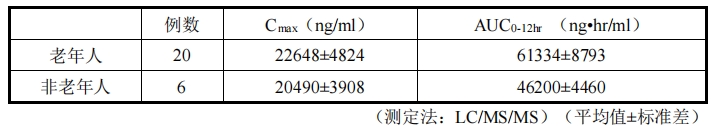
對健康老年受試者(65 歲以上)20 例、健康非老年受試者 6 例單次靜脈滴注 4mg/kg 注
2 ,藥代動力學參數如表 8 所示。老年受試者的 AUC 約為非老年受試者的 1.3 倍,但 Cmax
相近 (國外人的數據)。
表 8 老年人和非老年人藥代動力學參數對比
 注 1:本品已批準的成人最大用量為 600mg。
注 2:與本品已批準的成人用法用量不同。
|
|
【
藥理毒理
】
|
藥理作用
作用機制
帕拉米韋是環戊烷類抗流感病毒藥物,可結合于流感病毒神經氨酸酶的活性位點,對人
類A型和B型流感病毒有抑制活性。生化分析顯示帕拉米韋能抑制幾種A型和B型流感病毒株
的神經氨酸酶活性,對A型流感病毒株的中位IC50值為0.2nM(0.09~1.4nM,n=15),對于B
型流感病毒株的中位IC50值為1.32nM(0.60~11nM,n=8),對于2009H1N1A型流感病毒株(豬
流感)的IC50值范圍為0.06~0.26nM。
抗病毒活性
在細胞培養試驗中考察了帕拉米韋對實驗室株和臨床分離株的抗病毒活性。對季節性A
型H1N1流感株的EC50值為1μM(0.09~21μM,n=5),對A型H3N2流感株的EC50值為0.07μM
(<0.01~0.16μM,n=12),對B型H3N2流感株的EC50值為2.2μM(0.06~3.2μM,n=5)。細胞
培養中的抗病毒活性、神經氨酸酶抑制活性和人體中一直流感病毒復制之間的關系尚未建
立。有限的生化分析、細胞培養和動物模型數據顯示帕拉米韋和奧司他韋的抗病毒活性有協
同作用。尚無數據顯示帕拉米韋與扎那米韋有協同作用。在鼠流感A型病毒感染模型中,帕
拉米韋與奧司他韋聯合用藥顯示抗病毒活性增強,但其臨床意義尚不清楚。
耐藥性
尚無帕拉米韋耐藥性的臨床數據。細胞培養研究中發現,帕拉米韋耐藥株流感病毒
A/WSN/33(H1N1)的特征是H275Y基團。表達奧司他韋耐藥相關性H275Y基團的A型H1N1臨
床分離株亦顯示對帕拉米韋耐藥。已經在使用奧司他韋的患者的2009 H1N1中發現了H275Y
基團。至2009年9月5日,治療和未治療患者臨床分離株的耐藥率<1%。帕拉米韋的耐藥途徑
尚未完全明確。
交叉耐藥性
在流感病毒神經氨酸酶抑制劑中已發現了交叉耐藥性。在一項神經氨酸酶分析中,奧司
他韋耐藥基團E119V(A/H3N2)、D198N(B)、H275Y(A/H1N1)和R292K(H2N2)分別使對帕拉米
韋的敏感性下降了1、4.8、100和80倍;扎那米韋耐藥基團E119V(H4N2)、E119D(H4N2)、
E119G(H4N2)和R152K(B)分別使對帕拉米韋的敏感性下降了1、33、2和400倍。生化分析中
對帕拉米韋抑制作用的敏感性與臨床有效性之間的關系尚未建立。
毒理研究
遺傳毒性
帕拉米韋在鼠傷寒沙門菌和大腸桿菌菌的細菌回復突變結果為陰性。帕拉米韋濃度
≤3280μg/mL時CHO染色體畸變試驗結果為陰性。帕拉米韋≤360mg/kg劑量單次靜脈給藥時,
未見雌雄小鼠骨髓嗜多染紅細胞顯著性增加及明顯骨髓細胞增殖抑制。
生殖毒性
大鼠和家兔生育力及發育研究中均未見致畸作用。與人靜脈注射600mg劑量下的系統暴
露量(AUC=90μg·h/ml)相比,大鼠和家兔靜脈給藥帕拉米韋的暴露量分別為人的8.4倍和1.5
倍。妊娠家兔靜脈給予帕拉米韋200mg/kg,可導致嚴重的母體毒性(劑量限制性腎病),以
及與母體毒性相關的流產率增加和胚胎毒性。家兔被認為是敏感動物,在非妊娠家兔的一般
毒性研究中亦發現了腎臟毒性。與人靜脈注射600mg劑量下的AUC(90μg·h/ml)相比,非妊
娠家兔腎臟毒性的安全范圍小于1。在妊娠大鼠中,帕拉米韋劑量達600mg/kg未導致明顯的
母體毒性或胚胎毒性。
大鼠在妊娠第6至17天(GD6至17),經靜脈連續輸注帕拉米韋24h,劑量為50、400、
1000mg/kg/天,每日1次。與帕拉米韋有關的主要毒性反應為胎仔腎乳頭縮小、輸尿管擴張
和巨輸尿管癥。
致癌性
尚未開展帕拉米韋的動物長期致癌性研究。
|
|
【
貯藏
】
|
密閉,不超過 30℃保存。
|
|
【
包裝
】
|
中硼硅玻璃安瓿,4 支/盒。
|
|
【
有效期
】
|
24個月
|
|
【
執行標準
】
|
YBH12722024
|
|
【
批準文號
】
|
國藥準字H20244152 |
|
【
上市許可持有人
】
|
名稱:朗天藥業(湖北)有限公司
注冊地址:湖北省黃石市下陸區大泉路 120 號
|
|
【
生產企業
】
|
企業名稱:朗天藥業(湖北)有限公司
生產地址:湖北省黃石市下陸區大泉路 120 號
郵政編碼:435003
電話號碼:0714-6354581,6350072
|

